两公司蹭瑞德西韦热点遭处分 原料药"量产"是忽悠
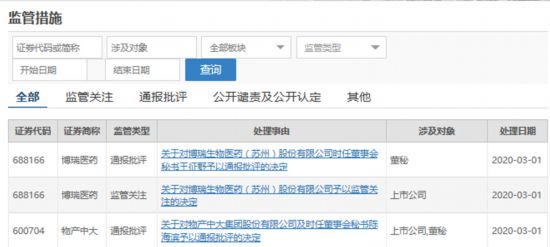
新京报讯(记者 李云琦)3月1日,在上交所官网披露监管措施显示,因对公司涉及瑞德西韦相关药物信息披露不完整等原因,决定对博瑞医药及公司董秘采取通报批评、监管关注的措施,对上市公司物产中大及公司董秘采取通报批评的监管措施。
数据显示,在2月12日、13日,博瑞医药、物产中大分别发布与瑞德西韦有关的利好消息,随后股价大涨。
瑞德西韦仍在进行三期临床试验 预计4月出结果
瑞德西韦,一款由美国公司吉利德生产的在研药物。根据吉利德介绍,瑞德西韦证实了对非典型性肺炎(SARS)和中东呼吸综合征(MERS)的病毒病原体均有活性,瑞德西韦还被紧急用于治疗埃博拉病毒感染者。目前,瑞德西韦已经在中国开展针对新型冠状病毒肺炎的三期临床试验。
此前北京时间2月27日吉利德科学宣布启动两项三期临床研究,以评估瑞德西韦在治疗新型冠状病毒肺炎成人患者中的安全性和有效性。从3月开始,这两项随机、开放、多中心的研究将主要在亚洲以及全球其他确诊病例较多的国家的医疗中心展开,入组约1,000名患者。研究将评估瑞德西韦静脉给药的两种用药时间方案。
吉利德表示,对于新型冠状病毒感染的重症患者研究已经在2月6日开始,对中症患者临床研究已经在2月13日开始,“吉利德为这些研究捐赠了药品并提供科学支持,在中国的临床试验预计四月份获得结果。”
吉利德此前在2月27日表示,为了应对近年来西非发的埃博拉疫情,吉利德增加了瑞德西韦的制造,以建立一批可用于应对未来流行病的产品库存,以及用于制造瑞德西韦的材料库存。并且,吉利德正在使用这些储备来满足目前的同情使用请求和在中国进行的两项临床试验所需的供应。
蹭瑞德西韦热点 博瑞医药将试验性生产说为“批量生产”
这款被认为最有可能应用于新型冠状病毒治疗的药物,在2月就引起了资本市场关注。
此前的2月11日晚间,博瑞医药在公告中表示,公司成功开发了瑞德西韦原料药合成工艺技术和制剂技术,并已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。
2月12日,博瑞医药董秘还在接受媒体采访中表示,公司的瑞德西韦生产“不是实验室的那种样品,而是可以批量生产”。
该消息发布后,让博瑞医药股票迅速上涨,在2月12日、13日、14日的涨幅分别达到了20.01%、19.99%、10.17%。
而根据上交所3月1日的监管措施决定显示,博瑞医药公告所称“批量生产”实际为药 品研发中小试、中试等批次的试验性生产。上交所称,博瑞医药尚未取得药监部门批准,也未取得专利权人授权,不具备进行药物商业化批量生产的应有资质。
上交所认为,博瑞医药在相关信息披露中未能明确区分相关药品试验性生产与商业化生产,信息披露不清晰、 不准确。董事会秘书王征野既是对 公司相关公告直接负责的主管人员,也是接受采访时进一步强化 相关不清晰、不准确表述的直接实施人员,对上述信息披露违规 负有主要责任。
在2月13日,上市公司物产中大也在“上证 e 互动”宣布旗下子公司江苏科本药业的 “抗新型冠状病毒肺炎特效药瑞德西韦10T/制剂1000万支”项目获得江苏省启东市北新镇人民政府备案通过。消息发布后物产中大股票涨停。
对于物产中大来说,是在2月13日晚间经监管层督促提交风险提示公告,补充提示瑞德西韦项目的不确定风险及科本药业本身对公司经营业绩无重大影响。
上交所认为,物产中大补充发布的风险提示过于概括,“也未作出有针对性 的风险提示,相关信息披露不完整。”物产中大上述行为违反了有关规定;时任公司董事会秘书陈 海滨作为上市公司信息披露事务的具体负责人,未能勤勉尽责, 对公司上述违规行为负有责任,对物产中大及公司董秘采取通报批评的监管措施。
分享让更多人看到 
相关新闻
- 评论
- 关注





















 第一时间为您推送权威资讯
第一时间为您推送权威资讯
 报道全球 传播中国
报道全球 传播中国
 关注人民网,传播正能量
关注人民网,传播正能量